Bệnh
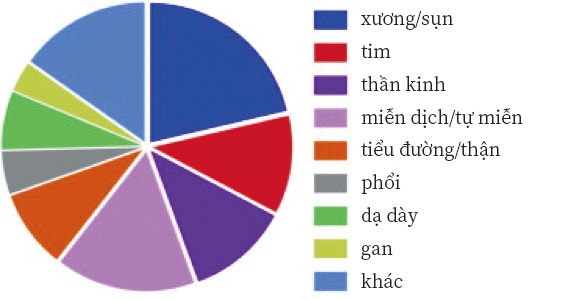
Indications Being Addressed using MSCs in Clinical Trials. Data for 352 registered clinical trials.
Citation// Stem Cell Therapies in Clinical Trials: Progress and Challenges. Trounson, Alan et al. Cell Stem Cell , Volume 17 , Issue 1 , 11 – 22
Tác dụng trẻ hóa ・các bệnh khác
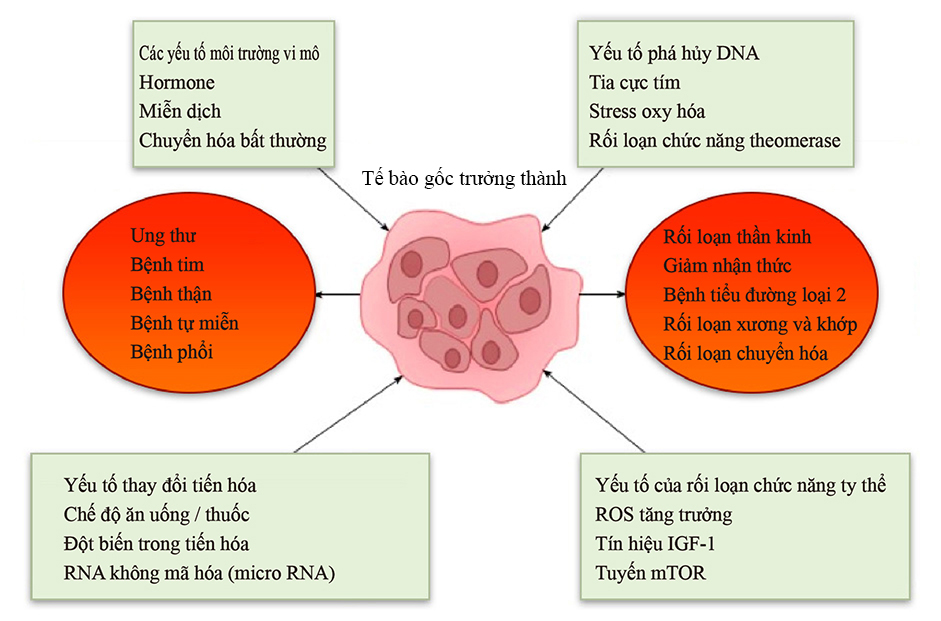
Citation// World J Exp Med. 2017 Feb 20; 7(1): 1–10.Effect of aging on stem cells. Abu Shufian Ishtiaq Ahmed,et al
Các bệnh khác・Gan / Tiểu đường
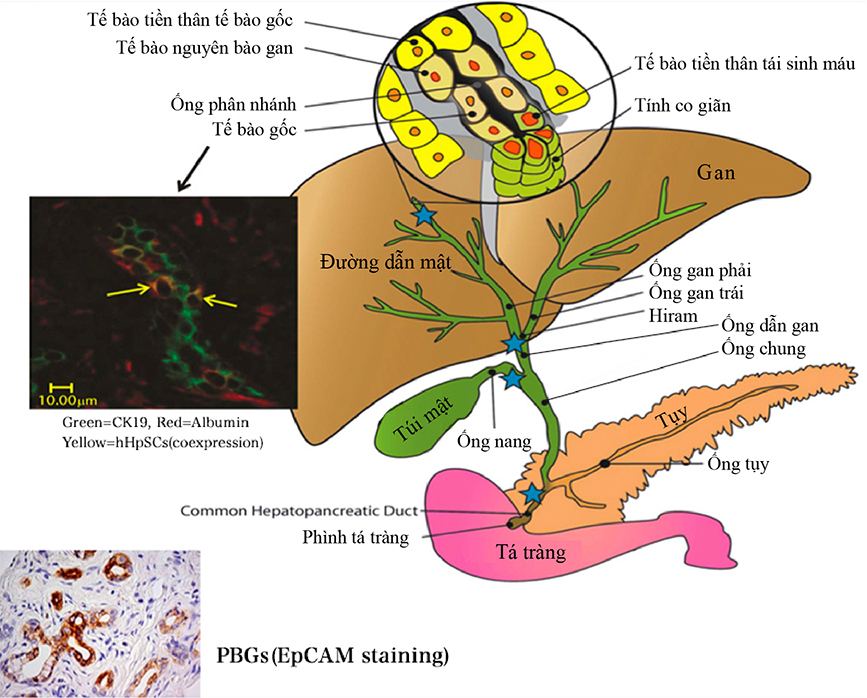
Y học tái sinh với mục đích phục hồi các tổ chức bị tổn thương đang chuyển sang chương trình lâm sàng sử dụng liệu pháp tế bào gốc / tế bào tiền thân. Tóm tắt về tế bào gốc ống mật ( hBTSC)phân bố ở ống mật, gan và tụy, cơ quan dùng chung tế bào gốc nội mô. Đây chính là thể tiền thân của tế bào gan/ tế bào tiền thân của ông dẫn herring và tế bào tiền thân của tuyến dẫn tụy. Chúng sinh ra hệ thống hoàn thiện chạy dọc theo trục bán kính thành trong của ống mật và sinh ra trục gần – trục xa bắt đầu từ tá tràng kết thúc ở tế bào trưởng thành trong gan hoặc tụy. Thử nghiệm lâm sàng đánh giá ảnh hưởng của tế bào gốc ( tế bào gốc gan từ gan thai nhi / tế bào tiền thân) được cấy ghép trong động mạch gan của bệnh nhân mắc các bệnh gan khác nhau đã được tiến hành trong thời gian dài. Việc ức chế miễn dịch là không cần thiết. Đối tượng thử nghiệm được chọn căn cứ theo tiêu chuẩn nhất định, hầu như các trường hợp đều không sống quá 1 năm hoặc chức năng gan rất kém. Những người thử nghiệm cấy ghép tế bào gan/ tế bào tiền thân trong 1 ~ 1,5 triệu ca đều cho thấy chức năng gan được cải thiện, thời gian sống được kéo dài. Hiệu quả và độ an toàn trong nuôi cấy vẫn đang trên đà phát triển. Liệu pháp tế bào gốc đối với bệnh tiểu đường sử dụng hBTSC vẫn đang được nghiên cứu nhưng sau các thành tựu thử nghiệm tiền lâm sàng này thì khả năng thực hiện tương đối cao. Ngoài ra, tế bào gốc mỡ trung mô ( MSC) và tế bào gốc tạo máu ( HSC) được sử dụng với các bệnh nhân bị bệnh gan mãn tính hoặc bệnh tiểu đường. Hiệu quả của HSC chủ yếu là điều tiết cơ cấu miễn dịch.
Stem Cells. 2013 Oct;31(10):2047-60. doi: 10.1002/stem.1457. Concise review: clinical programs of stem cell therapies for liver and pancreas.Lanzoni G1, Oikawa T
Bệnh tiểu đường
Mesenchymal Stem Cells as a Prospective Therapy for the Diabetic Foot
Stem Cells International Volume 2016, Article ID 4612167, 18 pages http://dx.doi.org/10.1155/2016/4612167
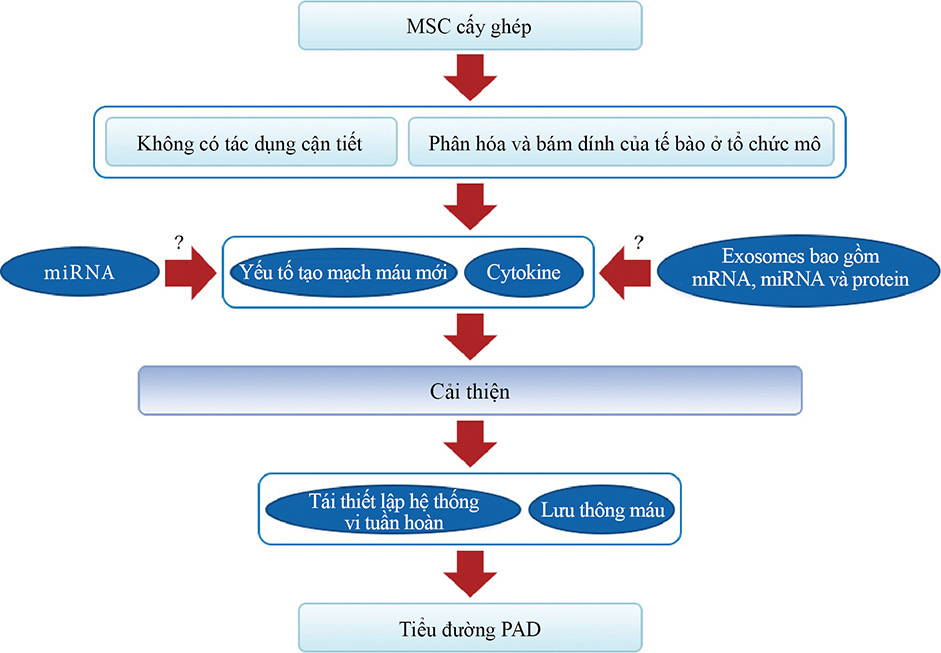
Hình 1: Cơ chế hiệu quả của việc cấy ghép MSC đối với bệnh tiểu đường PAD. Cơ chế phục hồi hiệu quả dựa vào việc cấy ghép tế bào gốc từ hai cách : cách một là phân tiết ra cytokine và yếu tố tái sinh máu, và một cách khác là phân hóa và cấy ghép thành phần cấu tạo tổ chức của tế bào. Tế bào gốc có thể cải thiện một cách đáng kể việc phát hiện và phân tiết cytokine và yếu tố tái sinh máu, đóng góp vào việc cải thiện chức năng của tế bào đảo tụyβ, lưu thông máu, và tái tạo của hệ thống vi tuần hoàn, giúp phục hồi bệnh tiểu đường PAD. Để nâng cao việc phục hồi rối loạn chức năng của các tế bào nội mô, thì tế bào gốc có thể phân hóa thành tế bào nội mô. Những tác động này có khả năng liên quan đến MEX và miRNA.
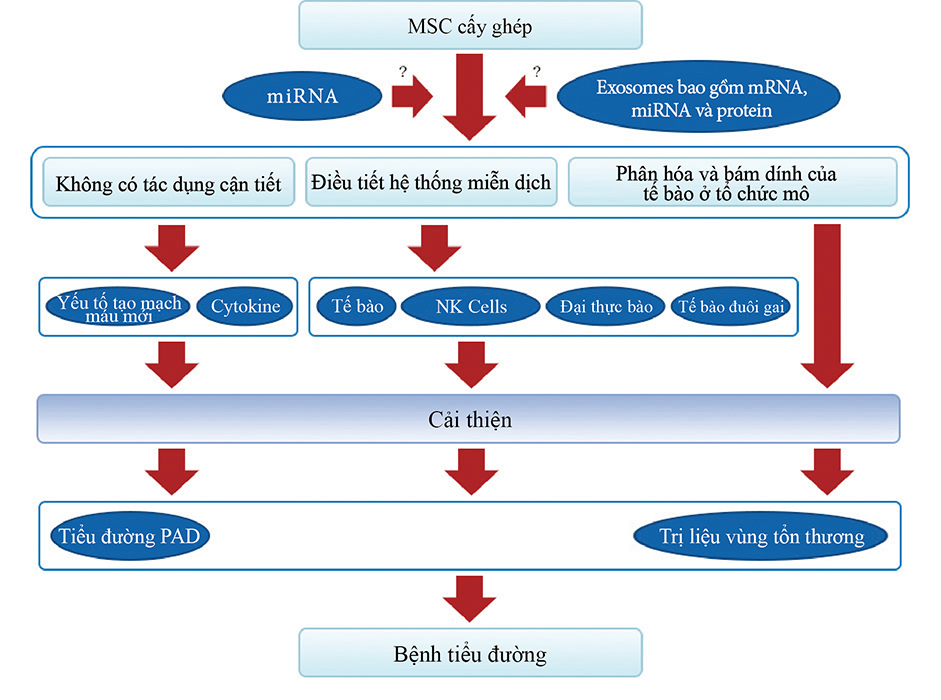
Hình 2: Cơ chế tác dụng của cấy ghép MSC trên vết thương do bệnh tiểu đường. Sửa chữa vết thương tiểu đường bằng cấy ghép MSC từ ba con đường: thứ nhất là tạo mạch và bài tiết các yếu tố và cytokine, thứ hai là điều hòa hệ thống miễn dịch và thứ ba là cấy ghép và biệt hóa tế bào thành các thành phần cấu tạo mô. Tế bào gốc có thể cải thiện cụ thể sự bài tiết tại chỗ và biểu hiện của các yếu tố tạo mạch và các cytokine góp phần cải thiện bệnh tiểu đường PAD và bệnh tiểu đường. Tế bào gốc cũng có thể điều chỉnh hoạt động của tế bào T, tế bào giết người tự nhiên, đại thực bào và tế bào đuôi gai, đồng thời có thể ức chế nhiễm trùng và phản ứng viêm. Ngoài ra, MSC có thể biệt hóa thành các mô đích để hoàn thành việc sửa chữa. Những hiệu ứng này có thể liên quan đến miRNA và MEX.
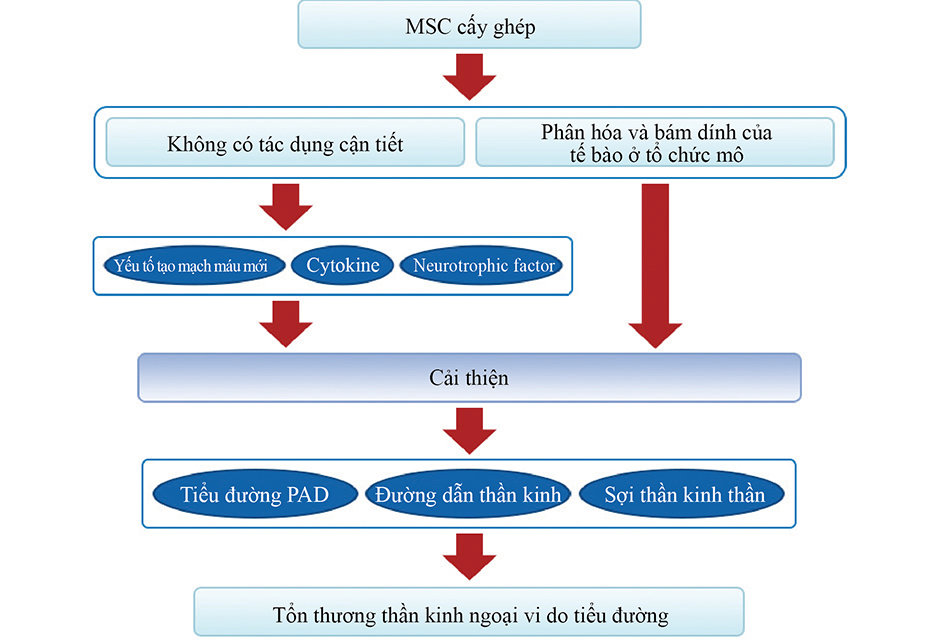
Hình 3: cơ chế hiệu quả của việc cấy ghép MSC đối với bênh lý thần kinh tiểu đường. Cơ chế phục hồi hiệu quả dựa vào việc cấy ghép tế bào gốc từ hai hướng: một là phân tiết yếu tố thần kinh và cytokine, hai là sự phân hóa và cấy ghép thành phần cấu tạo của tổ chức tế bào. Tế bào gốc có thể cải thiện một cách đáng kể việc phát hiện và phân tiết cytokine và yếu tố tái sinh máu, đóng góp vào việc cải thiện bệnh tiểu đường PAD và bệnh tiểu đường, đồng thời giúp cho việc phục hồi bệnh lý thần kinh tiểu đường. Yếu tố thần kinh cải thiện việc dẫn truyền thần kinh và rối loạn chức năng thần kinh sợi. Hơn nữa, tế bào gốc có thể phục hồi hoàn toàn sau khi phân hóa thành các mô đã chỉ định.
Suy thận
Stem Cell Research & Therapy 2014, 5:83 http://stemcellres.com/content/5/4/83
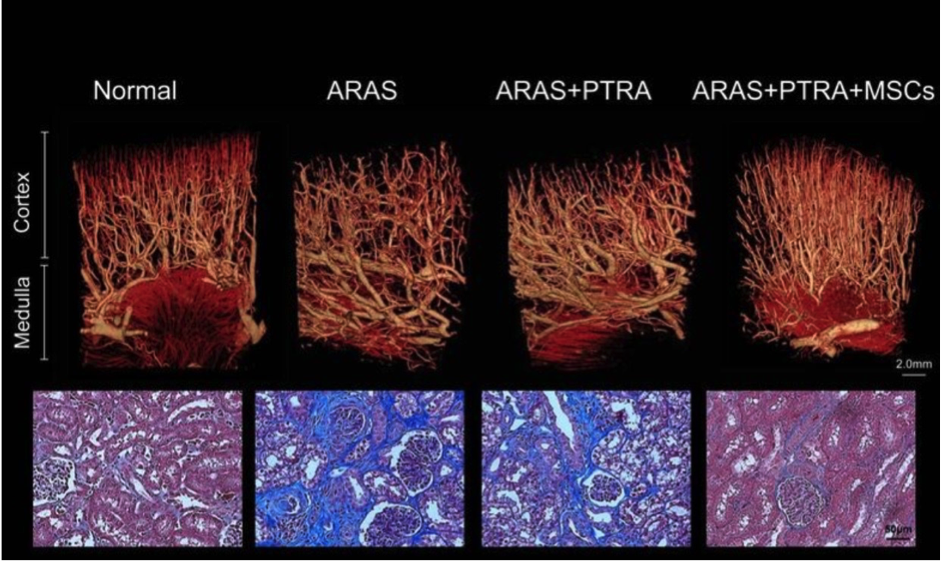
Động vật được điều trị bằng phương pháp tế bào gốc trung mô cho thấy tình trạng hẹp động mạch- tổn thương mạch máu thận và chứng xơ hóa đã được giảm đi đáng kể. Hình trên:Hình ảnh chụp cắt lớp vi tính 3D phân đoạn thận sau khi phẫu thuật nong mạch thận qua da (PTRA), trên lợn bị hẹp động mạch thận do xơ vữa , ta thấy cấu tạo của vi mạch máu có sự cải thiện sau 4 tuần tiêm vào thận tế bào gốc từ gốc mỡ trung mô ( MSC). Hình dưới: nhiễm sắc thận Trichrome tiêu biểu, biểu thị sự giảm thiểu xơ hóa MSC của lợn + ARAS + PTRA ( x40, sắc xanh)
Ví dụ ứng dụng lâm sàng của MSC: bệnh tiểu đường.
Cấy ghép tế bào gốc là phương pháp trị liệu hiệu quả và an toàn đối với bệnh nhân DM. Trong loạt thí nghiệm này, đối với T1DM đã đạt được kết quả trị liệu tốt nhất bằng phương pháp D34+HSC, tuy nhiên cũng quan sát thấy kết quả không tốt ở HUCB. Bệnh ketoacidosis tiểu đường gây cản trở hiệu quả trị liệu.
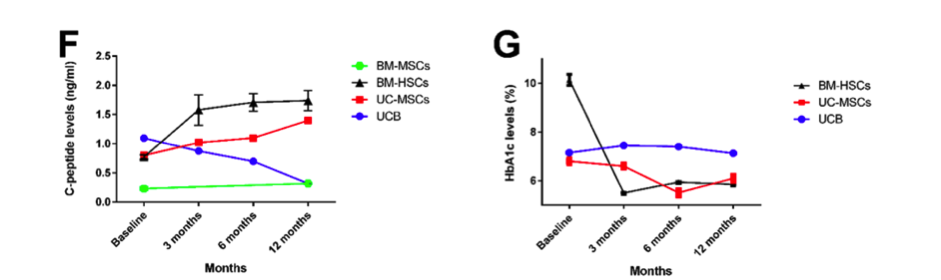
Biểu đồ đường thể hiện sự thay đổi nồng độ C-peptide và HbA1c tại thời điểm bắt đầu, 3 tháng, 6 tháng và 12 tháng sau khi điều trị tế bào gốc ở bệnh nhân T1DM. Tất cả các dữ liệu được thể hiện dưới dạng trung bình ± SEM. **** P 0,0001
The outcome for stem cell therapy for T2DM
Stem cell therapy for type 2 DM.
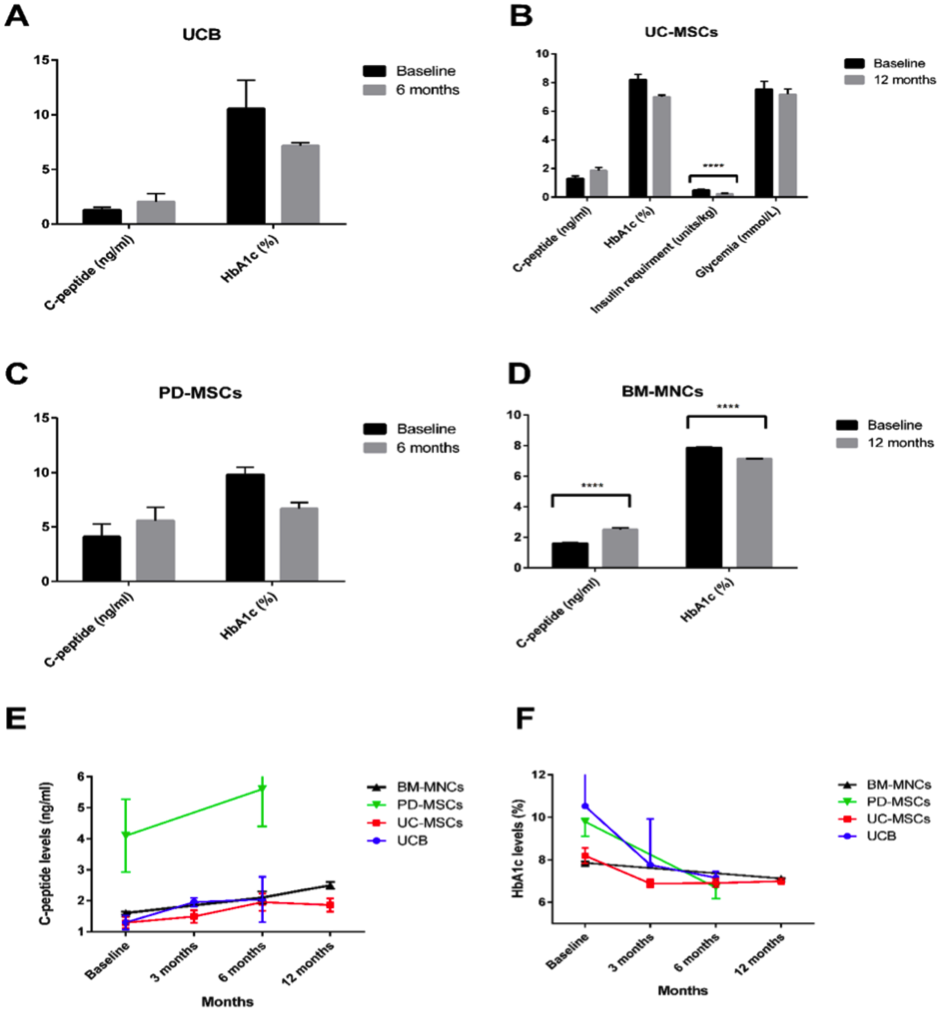
(A – D) Biểu đồ dạng thanh thể hiện những thay đổi trong mức C – peptide và HbA 1c sau 12 tháng sau khi dùng các loại tế bào gốc khác nhau. (E – F)Tiêm UC-MSC và PD-MSC vào tĩnh mạch (theo thứ tự là n=22 và n=10), trong khi đó tiêm BM-MNC và UCB vào tuyến tụy (n=3 và n=107). Biểu đồ đường thể hiện sự thay đổi nồng độ C-peptide và HbA1c tại thời điểm bắt đầu điều trị sau 3 tháng, 6 tháng và 12 tháng ở T2D
Citation// PLoS One. 2016 Apr 13;11(4):e0151938. Clinical Efficacy of Stem Cell Therapy for Diabetes Mellitus: A Meta-Analysis. El-Badawy A, El-Badri N.
Các bênh khác・Nang tóc
Fully functional hair follicle regeneration through the rearrangement of stem cells and their niches.
Toyoshima KE1, Asakawa K, Ishibashi N, Toki H, Ogawa M, Hasegawa T, Irié T, Tachikawa T, Sato A, Takeda A, Tsuji T.
Khái niệm
Y học tái sinh thay thế cơ quan của cơ thể, trong tương lai có khả năng thay thế các cơ quan nội tạng đã bị tổn thưởng do lão hóa hay bị thương. Ở đây chúng tôi thấy rằng sự tái tạo hoàn chỉnh các chức năng của nội tạng thông qua việc cấy ghép nội mô của mầm phôi và xương sinh học. Các bì phôi và noãn được tái cấu tạo bởi từng loại tế bào có nguồn gốc từ tế bào gốc trưởng thành và tế bào có nguồn gốc từ phôi thai. Các nang tóc sinh học phát triển cấu trúc chuẩn và hình thành các kết nối thích hợp với các mô chủ xung quanh như lớp biểu bì, cơ chân sau và các sợi thần kinh. Các nang tóc sinh học cũng cho thấy chu kỳ tóc, sự hình thành tóc phục hồi thông qua các tế bào gốc nang tóc và tái tổ chức thích hợp của chúng. Do đó, nghiên cứu này cho thấy tính khả thì của liệu pháp thay thế cơ quan sinh học của tế bào gốc năng tóc có nguồn gốc từ tế bào trưởng thành.
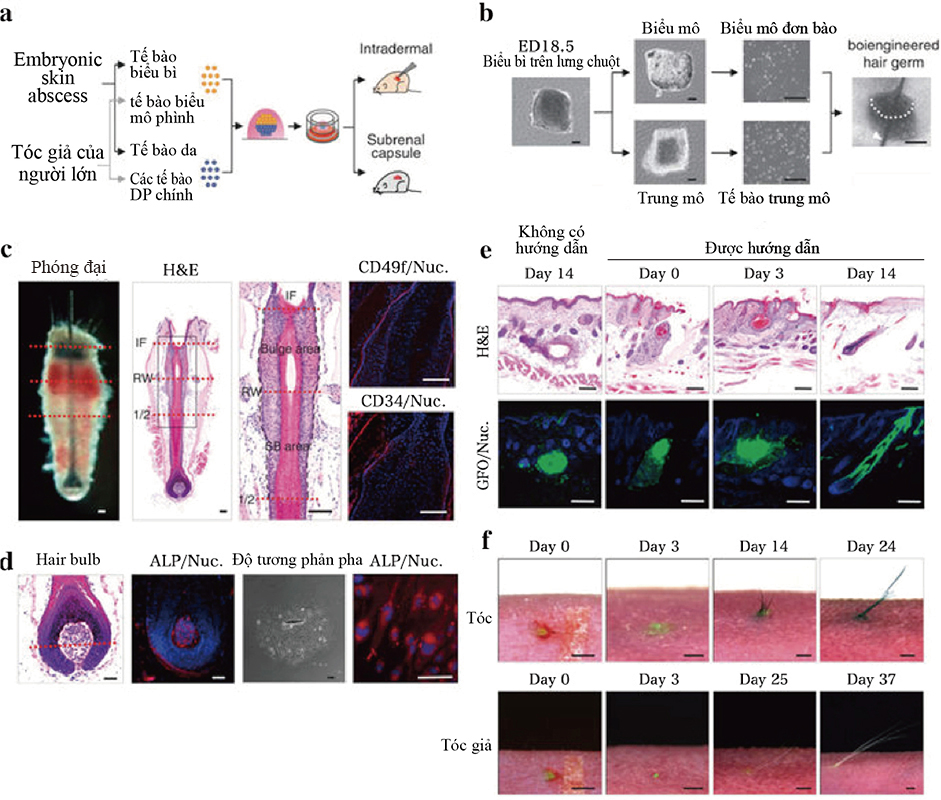
(a) Sơ đồ phương pháp được sử dụng trong cấy ghép và tạo ra phôi nang tóc sinh học (b) Hình ảnh của phôi nang tóc sinh học và tế bào đơn đã phân ly, tổ chức mô, biểu bì trên lưng của phôi chuột được tái tạo sau khi sử dụng liệu pháp phôi bằng sợi noron ( đầu mũi tên). Thanh tỉ lệ , 200μm. (c) Phân tích mô học của lông được phân lập từ một con chuột trưởng thành. Sự nhuộm màu và H & E của lông được thể hiện ở hai tấm bên trái. Đường đứt nét (màu đỏ) thông qua quan sát hình thái vĩ mô (trái) và nhuộm H & E (bên phải) cho biết giao diện của khu vực phình và SB. Khu vực đóng khung ở các tấm bên trái để chỉ ra chỗ phình ra, và khu vực SB được hiển thị ở độ phóng đại cao hơn ở bảng bên phải. Khu vực phình được nhuộm màu miễn dịch với kháng thể kháng CD49f (đỏ, trái) và kháng CD34 (đỏ, trung tâm) với thuốc nhuộm Hoechst 33258 (màu xanh). Các đường đứt gãy màu đen trong H & E có độ phóng đại cao biểu thị giao diện biểu mô của nang lông. IF, infundibulum; RW, ringwulst; 1/2, một nửa phần nang lông. Thanh tỷ lệ, 100 μm. (d) phân tích ALP và mô học của thời kì nuôi dưỡng ban đầu của tế bào DP và vùng phình ra của lông. Phân tích tế bào DP (2 hình bên phải) và bầu nang lông (2 hình bên trái) dựa vào màu nhuộm enzyme của ALP. Đường chấm chấm màu đỏ hiển thị đường Auber. Thanh tỉ lệ, 100μm. (e) Mặt cắt dọc của lông sinh học đang trong quá trình sinh sôi và phát triển dựa vào thiết bị kết nối mô liên kết với biểu mô (có hướng dẫn). Hình ảnh nang lông hình thành sau 14 ngày cấy ghép dưới da. (không kèm hướng dẫn). Hình ảnh H & E (trên) và kính hiển vi huỳnh quang (dưới) của nang lông sinh học sau 0, 3 và 14ngày nuôi cấy. Thanh tỉ lệ 100μm. (f) Các quan sát hình thái vĩ mô của sợi lông sinh học trong quá trình tăng trưởng và phát triển tại ngực (trên) và lá lách ( dưới) sau khi nuôi cấy ngày thứ 0 ( trái), ngày thứ 3 (trung tâm), ngày thứ 24, 27. Thanh tỷ lệ, 1,0 mm.
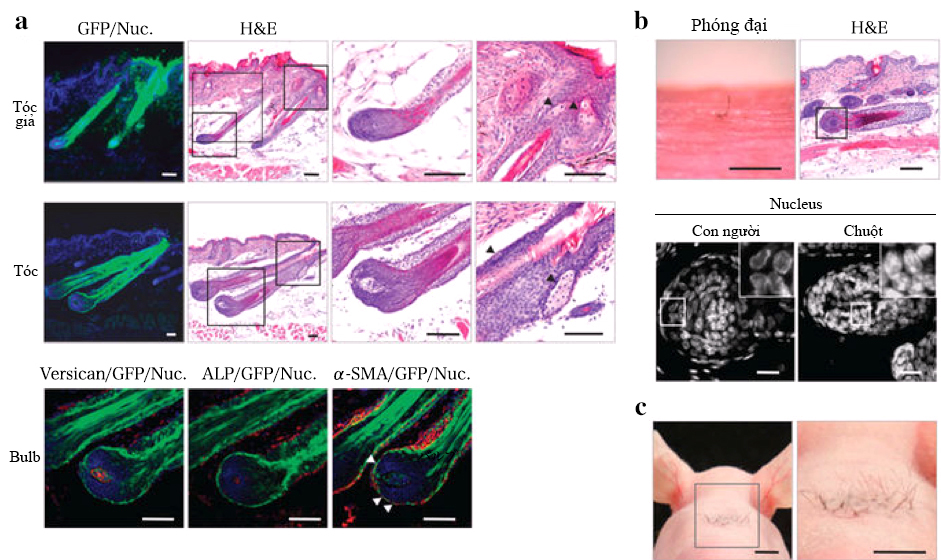
a) Phân tích tổ chức nang lông và tổ chức miễn dịch của các nang lông sinh học (trên) và lông giả (giữa). Các khu vực đóng khung trong các bảng H & E có độ phóng đại thấp được hiển thị ở độ phóng đại cao hơn trong các bảng bên phải. Đầu mũi tên biểu thị tuyến bã nhờn. Thanh tỷ lệ, 100 μm. Các bầu nang tóc đã nhuộm kháng thể α-SMA (đầu mũi tên, dưới bên phải), Anti-versican và ALP nhuộm enzyme (giữa, bên dưới). Thanh tỷ lệ, 50 μm. (b) Sợi tóc nhân tạo từ cấy ghép phôi nang sinh học đã được tái tạo bởi DP của các tế bào biểu mô và các nang tóc người. Tóc sinh học của người đã được chụp lại (kiểm tra bằng kính hiển vi) vào ngày thứ 21 sau khi cấy ghép và phân tích dựa vào nhiễm sắc H & E. Theo đặc điểm hình thái học (bảng bên phải), loài của các nang lông sinh học đã được phân tích. Vùng trong khung có độ phóng đại cao. Thanh tỉ lệ , kính hiển vi 500 μm, H & E 100 μm, hạt nhiễm sắc 20 μm. (c)Hình ảnh nuôi cấy phôi nang lông sinh học ở chuột. Nuôi cấy phôi nang lông sinh học tổng công 28 lông độc lập cấy ghép trên da cổ của chuột, hình ảnh nang lông trưởng thành mật độ cao sau khi nuôi cấy 21 ngày. nang lông và lông sinh học liên kết với các tổ chức như cơ vân, cơ kéo , sợi thần kinh có nguồn gốc từ tế bào vật chủ hoặc tế bào vật nhận. Tóc sinh học kết hợp với cơ trơn kết quả là tái sinh khu vực phình phát hiện NPNT có dạng khối kết tinh.
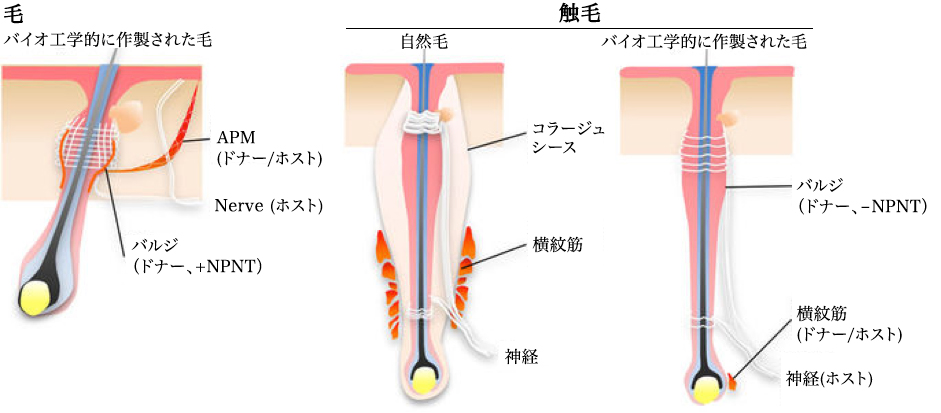
Các sợi lông và xúc tu biến đổi sinh học được kết nối với các mô khác như sợi thần kinh, cơ co rút và cơ vân có nguồn gốc từ tế bào chủ hoặc tế bào hiến tặng. Lông công nghệ sinh học liên kết với cơ trơn là kết quả của quá trình tái tạo vùng phình biểu hiện NPNT, tương tự như khối tự nhiên. Cả biểu hiện NPNT và liên kết cơ trơn đều không được phát hiện ở vùng phồng của lông công nghệ sinh học.
Trích dẫn/ Fully functional hair follicle regeneration through the rearrangement of stem cells and their niches. Koh-ei Toyoshima, Kyosuke Asakawa, Naoko Ishibashi, Hiroshi Toki, Miho Ogawa, Tomoko Hasegawa, Tarou Irié, Tetsuhiko Tachikawa, Akio Sato, Akira Takeda & Takashi Tsuji. Nature Communications 3, Article number: 784 (2012)
doi:10.1038/ncomms1784
Những bênh khác・Parkinson
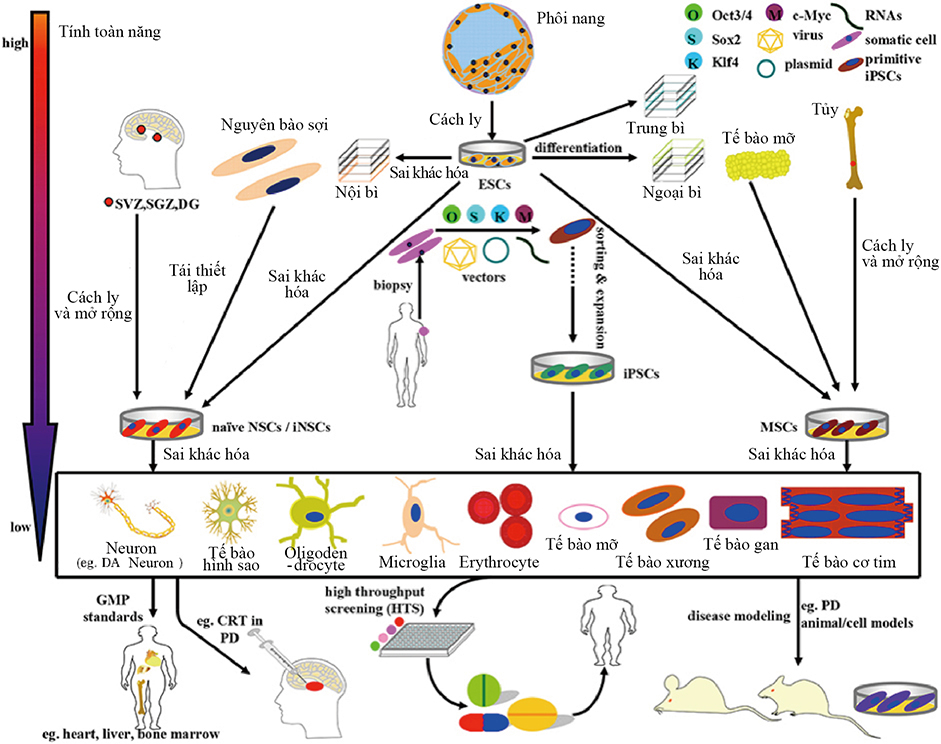
Sơ lược phân tích và ứng dụng khả năng hiện tại của tế bào gốc trong nghiên cứu PD và điều trị. Tế bào gốc ở trên có thể phân chia thành 4 dạng đó là ESC, NSC, MSC và iPSC. (1) ESC có nguồn gốc chủ yếu từ trong phôi nang, ở trạng thái thông thường có thể phân loại thành nội bì, trung bì, ngoại bì. Tùy vào từng trường hợp mà ESC cũng được phân hóa thành NSC và MSC. (2) NSC đã được lập trình lại từ nguyên bào sợi hoặc đơn ly trực tiếp từ sợi niche của não có thể tiến hành phân hóa hệ thống thần kinh đến tất cả các tế bào thần kinh và nơron. (3) MSC có khả năng phân hóa thành các tế bào trung bì đầu tiên có nguồn gốc chủ yếu từ tổ chức trung mô. Đặc biệt, MSC ngay cả dưới sự kết hợp của các giao thức cảm ứng cũng có thể phân hóa thành notron DA. (4)iPSCs có thể tái phân hóa từ tế bào của người trưởng thành (chẳng hạn như nguyên bào sợi) nhờ vào sự thâm nhập OSKM (Oct3 / 4, Sox2, Klf4, và c-Myc), đây là nguồn tế bào gốc đầy hứa hẹn có sở hữu khả năng phân hóa đa hệ. Căn cứ vào quy chuẩn của GMC, tế bào phân hóa cuối cùng và tế bào gốc ở trên có thể sắp xếp, tinh chế và mở rộng hơn để áp dụng cho mô hình bệnh, sàng lọc ma túy và thực hành CRT. Ví dụ như noron DA, ESC, MSC, và NSC được sử dụng như bên dưới. (i) chuẩn bị mô hình PD; (ii) sàng lọc ma túy có tiềm năng; (iii) Trị liệu CRT của PD. Front. Aging Neurosci., 31 May 2016. A Compendium of Preparation and Application of Stem Cells in Parkinson’s Disease: Current Status and Future Prospects. Yan Shen, Jinsha Huang